
- مؤلف Miles Stephen [email protected].
- Public 2023-12-15 23:33.
- آخر تعديل 2025-01-22 16:55.
ال التكافؤ الثانوي هو عدد أيونات الجزيئات التي يتم تنسيقها مع أيون المعدن. ال التكافؤ الثانوي يسمى أيضًا رقم التنسيق. مثال: في [Pt (NH3)6] Cl4 ، ال التكافؤ الثانوي من Pt تساوي 6 لأن Pt منسق مع 6 جزيئات من الأمونيا.
مع وضع هذا في الاعتبار ، ما هو شرح التكافؤ الأساسي والثانوي؟
يُظهر المعدن المركزي أو ذرات المعدن في مركبات التنسيق نوعين من تكافؤ . هم ال التكافؤ الابتدائي والثانوي . ال التكافؤ الأساسي يتعلق بحالة الأكسدة و التكافؤ الثانوي يتعلق برقم الإحداثيات. عدد ال التكافؤ الثانوي ثابت لكل ذرة معدنية.
بالإضافة إلى ذلك ، كيف تحسب التكافؤ الثانوي؟ ال التكافؤ الثانوي ثابت لمعدن ويساوي رقم التنسيق. يتم تحديد رقم التنسيق للذرة / الأيون المركزي فقط من خلال عدد روابط سيجما التي شكلتها الرابطة مع الذرة / الأيون المركزي وهذا يعطي التكافؤ الثانوي جدا.
من هنا ، ما هي التكافؤات الثانوية؟
ثانوي - التكافؤ . اسم. (جمع التكافؤ الثانوي ) (كيمياء) في مركب تنسيق ، عدد الأيونات أو الجزيئات المنسقة لأيون الفلز المركزي ؛ رقم تنسيقها.
ما هو التكافؤ الأساسي؟
ال التكافؤ الأساسي هو عدد الأيونات السالبة التي تعادل شحنة أيون المعدن. الثانوية تكافؤ هو عدد الروابط التي يتم ربطها أو تنسيقها مع أيون معدني.
موصى به:
ما هو تكوين إلكترون التكافؤ الأساسي للنيتروجين؟
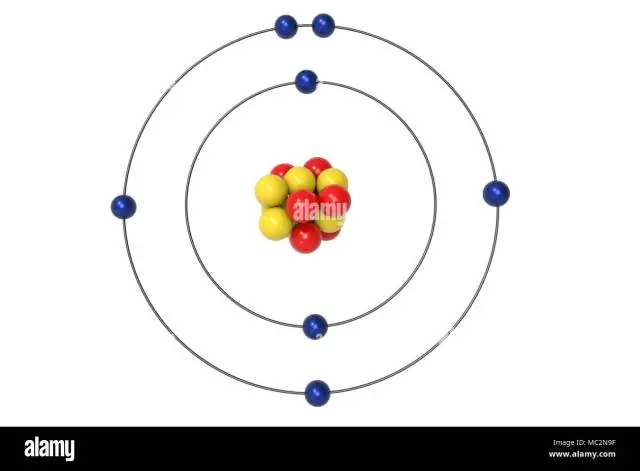
ستذهب الإلكترونات الثلاثة المتبقية في المدار 2p. لذلك سيكون تكوين الإلكترون N هو 1s22s22p3. يوفر تدوين التكوين للنيتروجين (N) طريقة سهلة للعلماء لكتابة وإيصال كيفية ترتيب الإلكترونات حول نواة ذرة النيتروجين
كم عدد إلكترونات التكافؤ في ذرة محايدة من الأستاتين؟

سبعة إلكترونات التكافؤ
كم عدد إلكترونات التكافؤ في الليثيوم؟

يحتوي الهيدروجين على إلكترون واحد في الغلاف الأول (أي إلكترون تكافؤ واحد). يحتوي الهيليوم على إلكترونين - كلاهما في الغلاف الأول (أي إلكترونان تكافؤان). يحتوي الليثيوم على 3 إلكترونات - 2 في الغلاف الأول ، وواحد في الغلاف الثاني (أي إلكترون واحد التكافؤ)
كم عدد إلكترونات التكافؤ في الكروم؟

يحتوي الكروم على ستة إلكترونات تكافؤ. العدد الذري للكروم هو 24 ، وتكوينه الإلكتروني هو 1s22s2 2p63s23p63d54s1 أو 2 ، 8 ، 13 ، 1 إلكترون لكل غلاف. تشكل الإلكترونات الموجودة في أغلفة 3d54s1 إلكترونات التكافؤ حيث تشارك الإلكترونات الخمسة في الغلاف ثلاثي الأبعاد في تكوين الرابطة الكيميائية
ما هو ناتج أكسدة الكحول الثانوي؟

تعتبر أكسدة الكحوليات الثانوية إلى الكيتونات تفاعل أكسدة مهم في الكيمياء العضوية. عندما يتأكسد كحول ثانوي ، يتحول إلى كيتون. يُفقد الهيدروجين من مجموعة الهيدروكسيل مع الهيدروجين المرتبط بالكربون الثاني
