
- مؤلف Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:33.
- آخر تعديل 2025-01-22 16:55.
بالنسبة لهم عالي شحنة نووي فعال، الهالوجينات للغاية كهربية . لذلك هم نكون شديد التفاعل و علبة اكتساب إلكترون من خلال التفاعل مع عناصر أخرى. الهالوجينات يمكن تكون ضارة أو قاتلة للكائنات البيولوجية بكميات كافية.
يجب أن تعرف أيضًا ، لماذا تمتلك المجموعة 17 أعلى كهرسلبية؟
كهرسلبية يزيد خلال فترة ، وينخفض إلى أسفل أ مجموعة . لذلك الفلور لديه أعلى كهرسلبية من بين جميع العناصر. لأن الفلور لديها سبعة إلكترونات تكافؤ ، تحتاج فقط إلى إلكترون واحد آخر لتحقيق تكوين غاز نبيل (ثمانية إلكترونات تكافؤ).
قد يتساءل المرء أيضًا ، ما هي الكهربية للهالوجينات؟ تعريف كهرسلبية هو سحب العنصر لمزيد من الإلكترونات. وبالتالي فإن VIIA أو الهالوجينات سيكون لديه أعلى كهرسلبية من أي عنصر في صفهم أو فترة. فلور رقم 9 F199 هو الأعلى كهرسلبية من أي عنصر في الجدول الدوري عند 4.0.
تعرف أيضًا ، أي الهالوجين يحتوي على أعلى كهرسلبية؟
الفلور
لماذا تسمى الهالوجينات بذلك؟
عناصر المجموعة 17 هي تسمى الهالوجينات لأن الهالوجين هي كلمة يونانية تعني "إنتاج الملح". الهالوجينات تشمل الفلور والكلور والبروم واليود والأستاتين. كلهم من غير المعادن. تتفاعل مع المعادن لتشكيل مركبات مسمى أملاح.
موصى به:
لماذا تميل الصهارة عالية السيليكا؟

اللزوجة هي مقاومة التدفق (عكس السيولة). تحتوي الصهارة ذات المحتوى العالي من SiO2 (السيليكا) على لزوجة أعلى من الصهارة ذات المحتوى المنخفض من SiO2 (تزداد اللزوجة مع زيادة تركيز SiO2 في الصهارة)
لماذا يحتوي المركب الأيوني على درجة انصهار وغليان عالية؟

تحتوي المركبات الأيونية على نقاط انصهار وغليان عالية نظرًا لوجود قوة جذب إلكتروستاتيكية قوية بين الأيونات المشحونة بشكل معاكس ، وبالتالي يلزم توفر كمية كبيرة من الطاقة لكسر قوة الترابط القوية بين الأيونات
هل الإمكانات الكهربية والطاقة الكامنة هي نفسها لماذا أو لم لا؟

طاقة الوضع الكهربائي Ue هي الطاقة الكامنة المخزنة عندما تكون الشحنات خارج التوازن (مثل طاقة وضع الجاذبية). الجهد الكهربائي هو نفسه ، لكن لكل شحنة ، Ueq. يسمى فرق الجهد الكهربائي بين نقطتين الجهد ، V = Ue2q & ناقص ؛ Ue1q
لماذا الماء لديه درجة انصهار عالية؟
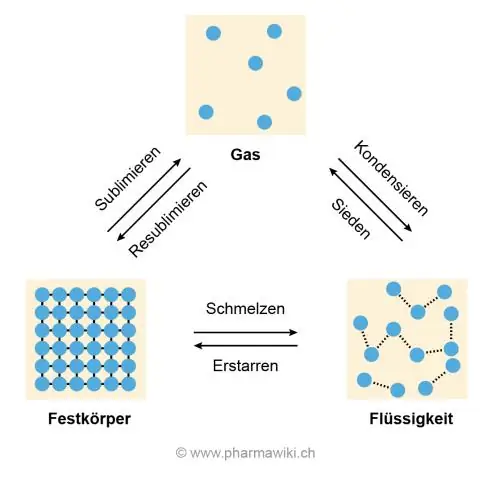
سبب ارتفاع درجة حرارة الانصهار والغليان هو الترابط الهيدروجيني بين جزيئات الماء التي تجعلها تلتصق ببعضها البعض وتقاوم الانقسام ، وهو ما يحدث عندما يذوب الجليد ويغلي الماء ليصبح غازًا
لماذا للصوديوم درجة انصهار عالية؟

يحتوي كلوريد الصوديوم على نقطة انصهار عالية بسبب التجاذب الكهروستاتيكي القوي بين أيوناته الإيجابية والسلبية ؛ هذا يتطلب المزيد من الطاقة الحرارية للتغلب عليها. تمتلك شركة Italso بنية شبكية عملاقة ، مما يعني أنها تحتوي على ملايين الروابط الأيونية القوية
